SOLUBILIDAD
Las proteínas son solubles en agua cuando adoptan una conformación globular. La solubilidad es debida a los radicales (-R) libres de los aminoácidos que, al ionizarse, establecen enlaces débiles (puentes de hidrógeno) con las moléculas de agua. Así, cuando una proteína se solubiliza queda recubierta de una capa de moléculas de agua (capa de solvatación) que impide que se pueda unir a otras proteínas lo cual provocaría su precipitación (insolubilización). Esta propiedad es la que hace posible la hidratación de los tejidos de los seres vivos.
CAPACIDAD AMORTIGUADORA
Esta propiedad se debe a la existencia de:
· Grupos ionizables de las cadenas laterales de los aminoácidos Asp, Glu, Lys, Arg, His, Tyr, Cys.
· Grupos COOH y NH2 terminales.
Las proteínas poseen un considerable poder amortiguador en una amplia zona de pH. Aunque cada AA tiene unos grupos ionizables con unas constantes de ionización (pKa) características, el valor de dichas constantes puede verse ligeramente modificado por el entorno proteico. El grupo imidazol del AA histidina es el principal responsable del poder amortiguador de las proteínas a pH fisiológico, ya que su pKa está próximo a 7.
Cuando el pH es bajo, los grupos ionizables están protonados, y la carga neta de la proteína es de signo positivo. Cuando el pH es alto, los grupos ionizables están desprotonados, y la carga neta es de signo negativo. Entre ambas zonas, habrá un pH en el cual la carga neta de la proteína es nula. Es el pH isoeléctrico o punto isoeléctrico, y es característico de cada proteína.
A valores de pH por debajo del pH isoeléctrico la carga neta de la proteína es positiva, y a valores de pH por encima del pH isoeléctrico, la carga neta de la proteína es negativa. La mayoría de las proteínas intracelulares tienen carga negativa, ya que su pH isoeléctrico es menor que el pH fisiológico (que está proximo a 7). Se llaman proteínas ácidas a aquellas que tienen un punto isoeléctrico bajo (como la pepsina), y proteínas básicas a las que tienen un punto isoeléctrico alto (como las histonas).
RECAMBIO PROTEICO
Casi todas las proteínas del organismo están en una constante dinámica de síntesis (1-2% del total de proteínas), a partir de aminoácidos, y de degradación a nuevos aminoácidos. Esta actividad ocasiona una pérdida diaria neta de nitrógeno, en forma de urea, que corresponde a unos 35-55 gramos de proteína. Cuando la ingesta dietética compensa a las pérdidas se dice que el organismo está en equilibrio nitrogenado.
BALANCE NITROGENADO
El balance nitrogenado puede ser positivo o negativo. Es positivo cuando la ingesta nitrogenada supera a las pérdidas, como sucede en crecimiento, embarazo, convalecencia de enfermedades. Es negativo si la ingesta de nitrógeno es inferior a las pérdidas, tal como ocurre en: desnutrición, anorexia prolongada, postraumatismos, quemaduras, deficiencia de algún aminoácido esencial.
VALOR BIOLOGICO DE LAS PROTEINAS
Es la medida de la absorción y síntesis en el cuerpo de la proteína procedente de la ingesta de alimentos. Las proteínas son la mayor fuente de nitrógeno en el cuerpo. La metabolización de las proteínas forma parte de un equilibrio, el cuerpo absorbe lo que necesita y el resto lo excreta de múltiples formas, el valor biológico es la fracción de nitrógeno absorbido y retenido por el organismo y esto representa la capacidad máxima de utilización de una proteína. Se suele mencionar en la literatura a veces como calidad de una proteína, las de mayor calidad poseen mayor valor biológico y por lo tanto son mejores para captar proteína. Las proteínas poseen valores diferentes dependiendo de la fuente, por ejemplo las proteínas de la soja poseen un valor biológico inferior al de la carne roja, los valores de las proteínas se pueden cambiar con combinaciones especiales de alimentos. La proteína con mayor valor biológico probado es la proteína del suero de leche.
NECESIDADES DIARIAS DE LAS PROTEINAS
La cantidad de proteínas que se requieren, depende de muchos factores. Depende de la edad, ya que en el período de crecimiento las necesidades son el doble o incluso el triple que para un adulto, y del estado de salud de nuestro intestino y nuestros riñones, que pueden hacer variar el grado de asimilación o las pérdidas de nitrógeno por las heces y la orina. También depende del valor biológico de las proteínas que se consuman, aunque en general, todas las recomendaciones siempre se refieren a proteínas de alto valor biológico. Si no lo son, las necesidades serán aún mayores.
En general, se recomiendan unos 40 a 60 gr (0,8 gr. por kilogramo de peso por día).
El máximo de proteínas que podemos ingerir sin afectar a nuestra salud, es un tema aún más delicado. Las proteínas consumidas en exceso, que el organismo no necesita para el crecimiento o para el recambio proteico, se queman en las células para producir energía. A pesar de que tienen un rendimiento energético igual al de los glúcidos, (unas 4 Kilocalorías por gramo) su combustión es más compleja y dejan residuos metabólicos, como el amoniaco, que son tóxicos para el organismo. El cuerpo humano dispone de eficientes sistemas de eliminación, pero todo exceso de proteínas supone cierto grado de intoxicación que provoca la destrucción de tejidos y, en última instancia, la enfermedad o el envejecimiento prematuro.
VIDA MEDIA DE LAS PROTEINAS
La vida media de las proteínas va desde muy pocos minutos hasta semanas o en algunos casos meses. De cualquier forma, las proteínas son continuamente sintetizadas y degradadas a los aminoácidos que las componen. El papel de este proceso en el metabolismo se puede ver desde dos puntos principales:
1.- para eliminar proteínas anormales cuya acumulación puede ser peligrosa para la vida celular
2.- para permitir la regularización del metabolismo celular eliminando proteínas reguladoras.

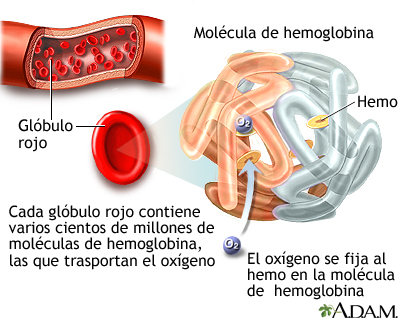
HEMOGLOBINA
La hemoglobina es una heteroproteína de la sangre, de peso molecular 68.000 (68 kD), de color rojo característico, que transporta el oxígeno desde los órganos respiratorios hasta los tejidos, en mamíferos, ovíparos y otros animales.
Hemoglobina, pigmento especial que predomina en la sangre cuya función es el transporte de oxígeno. Está presente en todos los animales, excepto en algunos grupos de animales inferiores. Participa en el proceso por el que la sangre lleva los nutrientes necesarios hasta las células del organismo y conduce sus productos de desecho hasta los órganos excretores. También transporta el oxígeno desde los pulmones o branquias, donde la sangre lo capta, hasta los tejidos del cuerpo.
La hemoglobina es una proteína contenida en los eritrocitos que constituye, aproximadamente, el 35% de su peso. Para combinarse con el oxígeno, los eritrocitos deben contenerla en cantidad suficiente y esto depende de los niveles de hierro que existan en el organismo, los cuales se obtienen de los alimentos por absorción en el tracto gastrointestinal y se conservan y reutilizan de forma continua.
TIPOS DE HEMOGLOBINA
· Hemoglobina A o HbA es llamada también hemoglobina del adulto o hemoglobina normal, representa aproximadamente el 97% de la hemoglobina degradada en el adulto, formada por dos globinas alfa y dos globinas beta.
· Hemoglobina A2: Representa menos del 2,5% de la hemoglobina después del nacimiento, formada por dos globinas beta y dos globinas delta, que aumenta de forma importante en la beta-talasemia, al no poder sintetizar globinas beta.
· Hemoglobina s: Hemoglobina alterada genéticamente presente en la Anemia de Células Falciformes. Afecta predominantemente a la población afroamericana y amerindia.
· Hemoglobina t
· Hemoglobina f: Hemoglobina característica del feto.
· Oxihemoglobina: Representa la hemoglobina que se encuentra unida al oxígeno normalmente ( Hb+O2)
· Metahemoglobina: Hemoglobina con grupo hemo con hierro en estado férrico, Fe (III). Ésta no se une al oxígeno, se produce por una enfermedad congénita en la cual hay deficiencia de metahemoglobina reductasa, la cual mantiene el hierro como Fe(III).
· Carbaminohemoglobina: se refiere a la hemoglobina unida al CO2 después del intercambio gaseoso entre los glóbulos rojos y los tejidos (Hb+CO2).
· Carboxihemoglobina: Hemoglobina resultante de la unión con el CO. Es letal en grandes concentraciones (40%). El CO presenta una afinidad 200 veces mayor que el Oxígeno por la Hb desplazándolo a este facilmente produciendo hipoxia tisular, pero con una coloración cutánea normal (produce coloración sanguínea fuertemente roja) (Hb+CO).
· Hemoglobina glucosilada: presente en patologías como la diabetes, resulta de la unión de la Hb con carbohidratos libres unidos a cadenas carbonadas con funciones ácidas en el carbono 3 y 4.
· Mioglobina: Hemoglobina presente en "el" músculo.
ESTRUCTURA Y FUNCION DE LA HEMOGLOBINA
La forman cuatro cadenas polipeptídicas (globinas) a cada una de las cuales se une un grupo hemo, cuyo átomo de hierro es capaz de unirse de forma reversible al oxígeno. El grupo hemo se forma por:
1. Unión de la Succinil CoA (formado en ciclo de Krebs o ciclo del acido cítrico) a un aminoácido glicina formando un grupo pirrol.
2. Cuatro grupos pirrol se unen formando la Protoporfirina IX.
3. La protoporfirina IX se une a una molécula de hierro ferroso (Fe2+) formando el grupo hemo.
ALTERACIONES ESTRUCTURALES Y SUS CONSECUENCIAS BIOLOGICAS
Las anomalías del valor de la hemoglobina en un individuo pueden indicar defectos en el equilibrio de los glóbulos rojos y tanto los valores altos como los bajos de dichos glóbulos rojos pueden ser indicio de estados patológicos.
Las alteraciones de la estructura de la hemoglobina pueden ocasionar enfermedades mortales. De éstas, la más importante es la anemia de células falciformes, que implica un cambio hereditario en uno de los aminoácidos que constituyen la molécula. Las talasemias son un grupo de enfermedades hereditarias con un origen similar.
La deficiencia de hemoglobina originada por la carencia de hierro conduce a la anemia.
Anemia, enfermedad de la sangre caracterizada por una disminución anormal en el número de glóbulos rojos (eritrocitos o hematíes) o en su contenido de hemoglobina. Los hematíes son los encargados de transportar el oxígeno al resto del organismo, y los pacientes anémicos presentan un cuadro clínico causado por el déficit de oxígeno en los tejidos periféricos. Existen diversas situaciones clínicas en las que están disminuidas las cifras de hemoglobina o la cantidad total de glóbulos rojos, sin que se pueda hablar de anemia: por ejemplo en situaciones en las que aumenta el volumen plasmático circulante como ocurre en el embarazo, en esfuerzos físicos intensos, o en situaciones de deshidratación.
Las anemias se pueden clasificar en dos grandes grupos: las anemias arregenerativas que se deben a una disminución en la producción de las células precursoras de hematíes o a una alteración de componentes fundamentales de los glóbulos rojos, como es la hemoglobina; y las anemias regenerativas o periféricas, debidas a una pérdida excesiva de glóbulos rojos o a un aumento en la destrucción de estas células, como ocurre en las anemias hemorrágicas o en las anemias hemolíticas por destrucción de eritrocitos por tóxicos o infecciones.
La anemia ferropénica es la más frecuente y se debe a un déficit de hierro, lo que origina una alteración de la síntesis de hemoglobina. La llamada anemia de los trastornos crónicos es la segunda en importancia y se produce en el transcurso de diversas enfermedades como el SIDA o la artritis reumatoide y se da sobre todo en pacientes hospitalizados. Anemia megaloblástica debida a un déficit de vitamina B12 (anemia perniciosa) y/o ácido fólico, en la que se ve alterada la formación de glóbulos rojos.
Anemia de células falciformes, proceso hereditario en el que la hemoglobina, proteína transportadora de oxígeno en la sangre, está alterada, con las consiguientes interrupciones periódicas en la circulación sanguínea. También se conoce como anemia drepanocítica.
VALORES DE REFERENCIA
· Hombre: de 13,8 a 17,2 gm/dl
· Mujer: de 12,1 a 15,1 gm/dl
COLAGENO Y ELASTINA
El colágeno, que forma parte de huesos, piel, tendones y cartílagos, es la proteína más abundante en los vertebrados. La molécula contiene por lo general tres cadenas polipeptídicas muy largas, cada una formada por unos 1.000 aminoácidos, trenzadas en una triple hélice siguiendo una secuencia regular que confiere a los tendones y a la piel su elevada resistencia a la tensión. Cuando las largas fibrillas de colágeno se desnaturalizan por calor, las cadenas se acortan y se convierten en gelatina.
Elastina, proteína fibrosa que, en los animales superiores, constituye un elemento básico estructural del tejido conjuntivo elástico de los ligamentos, de la piel, de los cartílagos, y de las paredes arteriales, principalmente.
Desde un punto de vista bioquímico, está constituida por cadenas polipeptídicas ordenadas en paralelo alrededor de un eje. Dichas cadenas se unen por medio de enlaces covalentes formando una lámina bidimensional a modo de red.
ESTRUCTURA Y FUNCION DEL COLAGENO
El colágeno es una proteína fibrosa, que se encuentra formando el 70% de la proteína de la piel (en el tejido conectivo de la dermis), también en el tejido conjuntivo de los cartílagos, huesos, en los ojos, uñas, pelo, etc.
La unidad esencial del colágeno está constituida por tres cadenas de polipéptidos que aparecen entrelazadas formando una tiple hélice, constituyendo una unidad macromolecular denominada "tropocolágeno".
El colágeno se encuentra especialmente en los cartílagos, los huesos, las uñas, el cabello; También lo tienen concentrado en altas proporciones en aquellas partes del organismo que transmiten fuerza., como los tendones (ligamentos que unen los músculos con las piezas esqueléticas). El colágeno en una de sus formas, constituye prácticamente un armazón de microfibrillas, que sostienen la estructura de los órganos y vísceras del organismo. Por ejemplo, los vasos sanguíneos que son tubulares, mantienen su forma, en funcion de que alrededor de la pared tienen una trama en espiral de fibrillas de colágeno que constituye el soporte de esa estructura tubular.
Mantiene la forma e impide la deformación de los tejidos, regula el mantenimiento de esa masa muscular, estimula la lipólisis (REDUCCION DE LA GRASA) y el volumen de las células grasas. Es benéfico para la prevención de la celulitis, porque auxilia el funcionamiento del sistema linfático, ayudando a regenerar las válvulas del flujo de linfa.
ESTRUCTURA Y FUNCIÓN DE LA ELASTINA
Corresponde a una proteína fibrosa, que al igual que el colágeno, forma parte de del tejido de los órganos de los mamíferos.
Proteína fibrosa que, en los animales superiores, constituye un elemento básico estructural del tejido conjuntivo elástico de los ligamentos, de la piel, de los cartílagos, y de las paredes arteriales, principalmente.
La Elastina tiene cumple la función de impartir elasticidad a los tejidos, algunos autores comparan la elasticidad de esta proteína con la elasticidad del caucho natural.Los tejidos que contienen en mayor porcentaje elastina corresponden a los tendones y a los vasos sanguíneos por ejemplo la aorta contiene cerca de un 50% de fibras de colágeno. La piel contiene entre un 1 a un 5% de elastina.
Desde un punto de vista bioquímico, está constituida por cadenas polipeptídicas ordenadas en paralelo alrededor de un eje. Dichas cadenas se unen por medio de enlaces covalentes formando una lámina bidimensional a modo de red.

INMUNOGLOBULINAS
Las inmunoglobulinas son glicoproteínas que, están formadas por cadenas polipeptídicas agrupadas, dependiendo del tipo de inmunoglobulina, en una o varias unidades estructurales básicas.
ESTRUCTURA Y FUNCION DE LAS INMUNOGLOBULINAS
Cada unidad está compuesta por cuatro cadenas polipeptídicas unidas entre sí por puentes disulfuro y otras uniones de tipo no covalente. Los polipéptidos de bajo peso molecular reciben el nombre de cadenas ligeras o cadenas L (Light) y las de alto peso molecular, cadenas pesadas o cadenas H (Heavy).
Dos cadenas ligeras y dos cadenas pesadas se agrupan de tal manera que existe una proximidad espacial entre los cuatro extremos amínicos de las cadenas ligeras y pesadas por una parte, y entre los dos extremos carboxílicos de las cadenas pesadas por otra.
Esta estructura básica de las inmunoglobulinas puede ser fraccionada mediante la utilización de enzimas (papaína, pepsina, etc.).
CADENAS LIGERAS
Hay dos tipos de cadenas ligeras, estructuralmente diferentes, que se conocen como cadenas ligeras tipo kappa (k) y cadenas ligeras tipo lambda (l). La familia de genes que codifica para la cadena ligera k se localiza en el cromosoma 2 y los loci de los genes homólogos que codifican para la cadena l, en el cromosoma 22. En cada molécula de inmunoglobulina las dos cadenas ligeras son del mismo tipo, k o bien l, pero nunca existe una de cada tipo en la misma inmunoglobulina.
Las cadenas ligeras están formadas por unos 200 aminoácidos con la particularidad de que existen dos puentes disulfuro que unen grupos de unos cincuenta aminoácidos. Concretamente la IgG1 posee 214 aminoácidos y su estructura secundaria y terciaria están determinadas por dos puentes disulfuro intracatenarios que unen los aminoácidos 23 con el 88 y 134 con el 193. A su vez, estas cadenas ligeras tienen otro puente disulfuro intercatenario, por el cual cada una de ellas se une a una cadena pesada para constituir la unidad básica de las inmunoglobulinas. Este puente se encuentra en el último aminoácido (214) de la parte carboxílica para el tipo k y en el penúltimo para el tipo l.
CADENAS PESADAS
Estas cadenas poseen unos cuatrocientos aminoácidos estableciéndose entre algunos de ellos puentes disulfuro (intracatenarios) que asocian unos 60 aminoácidos y que condicionan la estructura secundaria del polipéptido. Por ejemplo, las cadenas pesadas de la IgG1 poseen 440 aminoácidos y los puentes disulfuro unen el aminoácido 22 con el 96, el 144 con el 200, el 261 con el 321 y el 367 con el 425.
Estas dos cadenas pesadas están unidas la una a la otra por puentes disulfuro intercatenarios, ya indicados anteriormente, y que pueden ser de uno a cinco dependiendo del tipo de inmunoglobulina.
En estas cadenas pesadas, y a nivel de los puentes disulfuro intercatenarios, hay una zona de unos 15 aminoácidos, de gran flexibilidad debido a su estructura y constituye lo que se denomina zona bisagra por donde se deforma la molécula de inmunoglobulina cuando se produce la unión con el antígeno, facilitándose así su acoplamiento con éste. Los loci de los genes que codifican para la cadena pesada se localizan en el brazo largo del cromosoma 14.
PROPIEDADES Y FUNCIÓN DE CADA UNA DE LAS INMUNOGLOBULINAS
Son las inmunoglobulinas más abundantes y representan más del 70 % de las Igs séricas totales; las diferentes subclases se presentan en proporciones muy diferentes. La IgG1 es la subclase más frecuente (más del 60 %), seguida de la IgG2 (aproximadamente un 18 %), mientras que IgG3 e IgG4 se encuentran en mucha menor proporción.
Esta Ig posee capacidad neutralizante, precipitante, de fijar complemento, de unirse a células NK y a macrófagos (opsonización) y son capaces de atravesar activamente las membranas biológicas. La propiedad de atravesar activamente las membranas biológicas es de sumo interés por lo que, además de ejercer esta inmunoglobulina, su efecto en toda la “economía del organismo”, lo hace también en el feto al atravesar la placenta desde la madre, merced a la existencia de receptores para la porción Fc en el sincitiotrofoblasto.
Como el feto sólo sintetiza pequeñas cantidades de inmunoglobulinas, adquiere de este modo la posibilidad de defensa, no solamente mientras se encuentra en el seno materno, sino incluso durante la lactancia, período en el cual todavía no ha desarrollado la capacidad total de síntesis de inmunoglobulinas.
Sin embargo, este paso de IgG desde la madre al feto no siempre es beneficioso para el feto. De todos es sabido que cuando hay incompatibilidad del tipo Rh entre la madre y el feto, se puede desarrollar el síndrome de eritroblastosis fetal como consecuencia de la destrucción de glóbulos rojos fetales, de nefastas consecuencias si no se acude a tiempo. Esto no se presentaría si la IgG no pasase de la madre al feto
La IgG se sintetiza tardíamente tras un primer contacto con el antígeno, sin embargo, tras un segundo contacto la mayoría de las Igs formadas pertenecen a esta clase (Respuesta Secundaria).
Los anticuerpos del tipo IgM son los que mas rápidamente se forman en respuesta a un estímulo antigénico (Respuesta primaria). Esta Ig se caracteriza también por poseer capacidad neutralizante, precipitante, aglutinante, fijar complemento, activar la respuesta inmune, sin embargo no atraviesa activamente las membranas biológicas. Esta última propiedad hace que esta inmunoglobulina ejerza su acción normalmente en los espacios intravasculares.
Representa del 5 al 10 % de las Igs séricas totales y junto a la IgD es la más frecuentemente encontrada en la superficie de los linfocitos B como inmunoglobulina de membrana.
INMUNOGLOBULINA A
Esta inmunoglobulina posee capacidad neutralizante y precipitante, mientras que su capacidad de fijar complemento y de opsonización son muy débiles, limitándose su efecto a neutrófilos y no a macrófagos.
La propiedad más importante de esta inmunoglobulina viene determinada por su capacidad de unirse por el extremo Fc a la pieza secretora, gracias a la cual puede ser secretada por las mucosas y glándulas exocrinas, ejerciendo su acción más importante en la superficie de mucosas y líquidos biológicos (sobre todo IgA2), tales como el liquido cefaloraquideo, secreción bronquial, lágrima, saliva, etc. Esto es importante porque así protegen precisamente los puntos más vulnerables del organismo, esto es, las puertas de entrada al mismo, como son ojos, boca, aparato digestivo, sistema respiratorio, vagina, etc. No olvidemos que, por ejemplo, si desplegamos la mucosa del aparato respiratorio, la superficie que cubriríamos es de unos 300 m2, superficie que se encuentra en contacto directo con el exterior a través del aire que se respira. Se deduce de ello que, sin duda, deben ser importantes los mecanismos de defensa local entre los cuales la IgA tiene un papel esencial.
Esta inmunoglobulina se encuentra también en la leche materna. Los niveles de todas las inmunoglobulinas, a excepción de la IgG en recién nacidos son muy bajos, siendo por tanto de gran significación el hecho de que la IgA se transfiera desde la madre al lactante a través de la secreción láctea. De ahí que tengamos que insistir en que los lactantes se amamanten en el mayor grado posible directamente por las madres y no con leche de otros orígenes, a lo que actualmente existe excesiva tendencia.
La IgA recibida de la madre ejerce un importante papel de defensa a nivel de todo el aparato digestivo. En ello parece que influyen las especiales características de pH gástrico del lactante que es menos ácido que en el adulto y una especial resistencia de esta inmunoglobulina frente al mismo, por lo que no se destruye a su paso por el estómago.
INMUNOGLOBULINA D
La concentración de esta inmunoglobulina en suero es muy baja. Hasta fechas muy recientes no se había demostrado que esta inmunoglobulina poseía capacidad de unirse a antígenos, por lo que se dudaba de que actuase con función de anticuerpo. Sin embargo, aunque actualmente se ha demostrado su acción de anticuerpo, no se conoce con precisión cuáles son sus funciones específicas, aunque se piensa que colabora de forma importante en la activación de linfocitos B al actuar como receptor en la superficie de los mismos.
INMUNOGLOBULINA E
En muchos individuos alérgicos esta inmunoglobulina se presenta en grandes cantidades. El estímulo para su síntesis puede proceder de una gran variedad de antígenos, a los que en este caso se conocen como alergenos. Estos alergenos pueden penetrar en el organismo a través de la piel o de las mucosas respiratoria, ocular, del aparato digestivo, etc., así como por inyectables, como es el caso de la penicilina u otros medicamentos.
La vida media de la IgE en sangre periférica es de 24-48 horas. No tiene capacidad de atravesar la placenta, por lo tanto, las reacciones de hipersensibilidad inmediata no pueden transferirse de manera pasiva de la madre al feto. Sin embargo, puede existir una predisposición de tipo familiar a padecer enfermedades de naturaleza alérgica. Esta predisposición parece estar relacionada con una tendencia a producir anticuerpos de tipo IgE en la respuesta secundaria frente a antígenos, en lugar de IgG que seria la respuesta normal en individuos no alérgicos.
La IgE se encuentra en forma libre en sangre, en donde se observa que los niveles cambian a lo largo de la edad. También la IgE se encuentra en otros líquidos biológicos, así como unidos a basófilos y células cebadas, gracias a la propiedad que tiene esta inmunoglobulina de unirse por su extremo Fc a receptores de superficie presentes en dichas células. Estas células se caracterizan por encontrarse en la piel y mucosas y por contener abundantes gránulos citoplasmáticos, ricos en sustancias vasoactivas que liberan una vez se activan.

ALTERACIONES EN LAS CONFORMACIONES DE LAS PROTEINAS
PRIONES
Agente infeccioso que no contiene ácido nucleico, sino una forma anormal de glicoproteína, una proteína celular que normalmente se encuentra en el hospedador. De estructura más elemental que los virus, los priones causan enfermedades en los seres humanos y en los animales. Antes de la identificación de los priones, estas enfermedades, conocidas colectivamente como encefalopatías espongiformes transmisibles (patologías que cursan con degeneración del cerebro) estaban vinculadas sólo por la similitud de los síntomas; recientemente se ha demostrado que tienen una causa común.
La proteína infecciosa o prión, identificada con las siglas PrPSC es una forma anormal, con una configuración distinta, de la proteína prión (PrPC), componente normal de las membranas neuronales de los mamíferos. En los seres humanos la proteína prión se codifica por un gen (PrP) situado en el brazo corto del cromosoma 20. La función biológica de la proteína normal no se conoce con exactitud, aunque sí se han determinado las características de su estructura. La proteína normal está compuesta por 253 aminoácidos plegados en tres largas espirales, conocidas como hélices alfa. La forma infecciosa de esta proteína o prión presenta exactamente la misma secuencia de aminoácidos. No obstante, en lugar de plegarse en forma de hélice lo hace mediante un plegamiento plano, semejante al de un acordeón parcialmente abierto. La forma patógena se caracteriza por su resistencia parcial a las proteasas; además, es muy resistente a las altas temperaturas y no produce ningún tipo de reacción en el sistema inmunológico.
No se sabe con exactitud cómo afecta el PrPSC al hospedador, pero puede replicarse transformando la proteína prión normal sintetizada por el hospedador en PrP anormal. Algunos científicos creen que la proteína alterada causa enfermedad simplemente cuando contacta con la proteína normal, obligando a ésta a cambiar su configuración, pasando de un plegamiento en forma de hélice a una forma aplanada y transformándola en una proteína patógena. Las nuevas proteínas pueden inducir el cambio de configuración en otras proteínas normales iniciando así una reacción en cadena.

ENFERMEDAD DE ALZHEIMER
Enfermedad de Alzheimer, enfermedad degenerativa que afecta al cerebro y que origina un deterioro gradual y progresivo de la memoria, la percepción del tiempo y el espacio, el lenguaje y, finalmente, la capacidad de cuidar de uno mismo. La enfermedad fue descrita por primera vez en 1906 por el psiquiatra alemán Alois Alzheimer. Al principio se pensaba que esa enfermedad era un trastorno poco frecuente que afectaba solo a gente joven, por lo que se consideró una forma de demencia presenil. Hoy en día, la enfermedad de Alzheimer de inicio tardío se considera la causa más importante de demencia en la población por encima de los 65 años. La enfermedad que aparece en personas de 30, 40 o 50 años, llamada enfermedad de Alzheimer de inicio temprano, es mucho menos frecuente.
Aunque la enfermedad de Alzheimer no forma parte del proceso normal del envejecimiento, el riesgo de desarrollar la enfermedad aumenta con la edad. La enfermedad de Alzheimer es devastadora, no solo para los pacientes, sino también para la familia y aquellas personas que atienden al enfermo. Algunos pacientes sienten grandes temores y frustraciones al intentar realizar las actividades cotidianas y advertir como pierden lentamente su independencia. La familia, los amigos y sobretodo los encargados de su cuidado diario, experimentan un sufrimiento y estrés importantes conforme son testigos de cómo la enfermedad va arrebatándoles lentamente a su ser querido.
En el cerebro de los pacientes con Alzheimer se detectan hallazgos microscópicos diferenciados: ovillos neurofibrilares y placas de proteínas anómalas, que se consideran el elemento característico de la enfermedad. No todas las regiones cerebrales presentan esas lesiones. Las zonas más afectadas son las relacionadas con la memoria.
Los ovillos son largos filamentos gruesos presentes en el interior de las células nerviosas o neuronas. Los científicos han descubierto que cuando una proteína denominada tau se altera, puede formar los ovillos característicos en el cerebro de un paciente con Alzheimer. En el cerebro sano esa proteína tau proporciona soporte estructural a las neuronas, pero en el paciente con Alzheimer ese soporte estructural se colapsa.
Las placas o acumulaciones se forman fuera de las neuronas, en el tejido cerebral adyacente. Se ha descubierto que un tipo de proteína, denominada proteína precursora amiloide, forma placas tóxicas cuando se degrada. Los investigadores han identificado la enzima beta-secretasa, que se cree que es responsable de una de las dos escisiones de la proteína precursora amiloide. También se ha identificado otra enzima, denominada gamma-secretasa, responsable de la segunda escisión de la proteína precursora amiloide. Esas dos enzimas rompen la proteína precursora amiloide en fragmentos, que después se acumulan para formar placas que son tóxicas para las neuronas.
Los científicos han observado en el cerebro de los pacientes con Alzheimer que los ovillos y las placas producen la contracción y, con el tiempo, la muerte de las neuronas, al principio en los centros de la memoria y el lenguaje, y finalmente en todo el cerebro. Esa degeneración neuronal generalizada produce defectos en la red de conexiones cerebrales que pueden interferir con la comunicación entre las neuronas, provocando algunos de los síntomas de la enfermedad de Alzheimer.
Los pacientes con Alzheimer tienen una concentración menor de neurotransmisores, sustancias que envían mensajes entre las neuronas. Por ejemplo, parece que la enfermedad de Alzheimer disminuye la concentración del neurotransmisor acetilcolina, que se sabe que participa en la memoria. Una deficiencia de otros neurotransmisores como la somatostatina y el factor liberador de corticotropina, sobre todo en los pacientes más jóvenes, la serotonina y la noradrenalina, interfiere también con la comunicación normal entre las neuronas.

DESNATURALIZACION
La desnaturalización es un cambio estructural de las proteínas, donde pierde su estructura nativa, y de esta forma su óptimo funcionamiento y a veces también cambian sus propiedades físico-químicas.
Las proteínas se desnaturalizan cuando pierden su estructura tridimensional y así el característico plegamiento de su estructura.
es alterada por algún factor externo (por ejemplo, aplicándole calor, ácidos o álcalis), no es capaz de cumplir su función celular.
CÓMO LA DESNATURALIZACIÓN AFECTA A LOS DISTINTOS NIVELES
En la desnaturalización de la estructura cuaternaria, las subunidades de proteínas se separan o su posición espacial se corrompe.
La desnaturalización de la estructura terciaria implica la interrupción de:
Ø Enlaces covalentes entre las cadenas laterales de los aminoácidos (como los puentes disulfuros entre las cisteínas).
Ø Enlaces no covalentes dipolo-dipolo entre cadenas laterales polares de aminoácidos.
Ø Enlaces dipolo inducidos por fuerzas de Van Der Waals entre cadenas laterales no polares de aminoácidos.
En la desnaturalización de la estructura secundaria las proteínas pierden todos los patrones de repetición regulares como las hélices alfa y adoptan formas aleatorias.
— La estructura primaria, la secuencia de aminoácidos ligados por enlaces peptídicos, no es interrumpida por la desnaturalización.
PÉRDIDA DE FUNCIÓN
La mayoría de las proteínas pierden su función biológica cuando están desnaturalizadas, por ejemplo, las enzimas pierden su actividad catalítica, porque los sustratos no pueden unirse más al centro activo, y porque los residuos del aminoácido implicados en la estabilización de los sustratos no están posicionados para hacerlo.
EJEMPLOS
Cuando se cocina el alimento, algunas de sus proteínas se desnaturalizan. Esta es la razón por la cual los huevos hervidos llegan a ser duros y la carne cocinada llega a ser firme.
EFECTOS DE LA TEMPERATURA, ACIDOS, BASES Y METALES PESADOS
La desnaturalización provoca diversos efectos en la proteína:
1. cambios en las propiedades hidrodinámicas de la proteína: aumenta la viscosidad y disminuye el coeficiente de difusión
2. una drástica disminución de su solubilidad, ya que los residuos hidrofóbicos del interior aparecen en la superficie
3. pérdida de las propiedades biológicas
EXISTEN DIFERENTES FACTORES
º Físicos
º Químicos
TEMPERATURA
Destruye las interacciones débiles y desorganiza la estructura de la proteína, de forma que el interior hidrofóbico interacciona con el medio acuoso y se produce la agregación y precipitación de la proteína desnaturalizada.
PH
Los iones H+ y OH- del agua provocan efectos parecidos, además de afectar a la envoltura acuosa de las proteínas también la carga eléctrica de los grupos ácidos y básicos de las cadenas laterales de los aminoácidos. Esta alteración de la carga superficial de las proteínas elimina las interacciones electrostáticas que estabilizan la estructura terciaria y a menudo provoca su precipitación. La solubilidad de una proteína es mínima en su punto isoeléctrico, ya que su carga neta es cero y desaparece cualquier fuerza de repulsión electrostática que pudiera dificultar la formación de agregados.
Cuando el pH es bajo, los grupos ionizables están protonados, y la carga de la proteína es de signo positivo. Cuando el pH es alto, los grupos ionizables están desprotonados, y la carga es de signo negativo. Entre ambas zonas, habrá un pH en el cual la carga neta de la proteína es nula. Es el PH isoeléctrico o punto isoeléctrico, y es característico de cada proteína.
FUERZA IONICA
METALES PESADOS
Los iones de algunos metales pesados, tales como el plomo (Pb ) y el mercurio ( Hg ), precipitan a las proteínas y, por lo tanto inactivan las enzimas. Normalmente, las enzimas están en suspensión dentro del citoplasma o unidas a una biomembrana. Si los iones de un metal pesado se combinan con una enzima en suspensión, la molécula proteica precipita, perdiendo su eficacia como enzima.
EFECTOS DE LA DESNATURALIZACION SOBRE LA ACTIVIDAD BIOLOGICA
RENATURALIZACION
Algunas proteínas globulares desnaturalizadas por el calor, extremos de pH o reactivos desnaturalizantes pueden recuperar su estructura nativa y su actividad biológica si son devueltas a condiciones en las que la conformación nativa es estable, lo cual se denomina RENATURALIZACION.
Esto se debe a que la desnaturalización no afecta a los enlaces peptídicos y al volver a las condiciones normales, puede darse el caso de que la proteína recupere la conformación primitiva.
PARA LA RENATURALIZACION DE PROTEINAS DESNATURALIZADAS DISUELTAS EN UN TAMPON DE RENATURALIZACION. SE PREPARA UNA DISOLUCION DE CONCENTRACION CRITICA DE LA PROTEINA EN EL TAMPON ELEGIDO, Y, UNA VEZ QUE SE FORMA EL PRODUCTO INTERMEDIO, SE AÑADE MAS PROTEINA A RENATURALIZAR EN LA CANTIDAD NECESARIA PARA ALCANZAR LA CONCENTRACION CRITICA.

Estudio de los procesos mediante los cuales las células vivas utilizan, almacenan y liberan energía. El componente principal de la bioenergética es la transformación de energía, es decir, la conversión de una forma de energía en otra.
Todas las células transforman energía. Por ejemplo, las células vegetales utilizan la luz solar para obtener carbohidratos (azúcares y almidón) a partir de principios químicos inorgánicos simples. En este proceso, denominado fotosíntesis, la energía solar se convierte en energía química de reserva. Si los carbohidratos de estas plantas son ingeridos por un animal, se produce su ruptura y su energía química se transforma en movimiento (energía cinética), calor corporal o enlaces químicos nuevos.
En toda esta serie de transformaciones, existe una pérdida de energía hacia el medio ambiente, generalmente en forma de energía térmica (calor). Esta energía no puede generar trabajo útil debido a que se ha liberado. La segunda ley de la termodinámica establece que, con el tiempo, cualquier sistema tiende a un desorden mayor; es decir, incrementa su entropía. La constante afluencia de energía solar es necesaria para la supervivencia de todas las plantas y animales de la Tierra.

CONCEPTOS DE SISTEMA
Es una colección organizada de hombres, máquinas y métodos necesaria para cumplir un objetivo específico.
LOS SERES VIVOS COMO SISTEMAS
Los seres son considerados sistemas, debido a que están constituidos por órganos que funcionan específicamente para cumplir su función adecuada dentro de su proceso biológico.
LOS SERES VIVOS Y LAS LEYES DE LA TERMODINAMICA
Termodinámica, campo de la física que describe y relaciona las propiedades físicas de la materia de los sistemas macroscópicos, así como sus intercambios energéticos. Los principios de la termodinámica tienen una importancia fundamental para todas las ramas de la ciencia y la ingeniería.
Un concepto esencial de la termodinámica es el de sistema macroscópico, que se define como un conjunto de materia que se puede aislar espacialmente y que coexiste con un entorno infinito e imperturbable. El estado de un sistema macroscópico se puede describir mediante propiedades medibles como la temperatura, la presión o el volumen, que se conocen como variables de estado. Es posible identificar y relacionar entre sí muchas otras variables termodinámicas (como la densidad, el calor específico, la compresibilidad o el coeficiente de dilatación), con lo que se obtiene una descripción más completa de un sistema y de su relación con el entorno. Todas estas variables se pueden clasificar en dos grandes grupos: las variables extensivas, que dependen de la cantidad de materia del sistema, y las variables intensivas, independientes de la cantidad de materia.
PRIMERA LEY DE LA TERMODINAMICA
La primera ley de la termodinámica da una definición precisa del calor, otro concepto de uso corriente.
Cuando un sistema se pone en contacto con otro más frío que él, tiene lugar un proceso de igualación de las temperaturas de ambos. Para explicar este fenómeno, los científicos del siglo XVIII conjeturaron que una sustancia que estaba presente en mayor cantidad en el cuerpo de mayor temperatura fluía hacia el cuerpo de menor temperatura. Según se creía, esta sustancia hipotética llamada “calórico” era un fluido capaz de atravesar los medios materiales. Por el contrario, el primer principio de la termodinámica identifica el calórico, o calor, como una forma de energía. Se puede convertir en trabajo mecánico y almacenarse, pero no es una sustancia material. Experimentalmente se demostró que el calor, que originalmente se medía en unidades llamadas calorías, y el trabajo o energía, medidos en julios, eran completamente equivalentes. Una caloría equivale a 4,186 julios.
El primer principio es una ley de conservación de la energía. Afirma que, como la energía no puede crearse ni destruirse , dejando a un lado las posteriores ramificaciones de la equivalencia entre masa y energía, la cantidad de energía transferida a un sistema en forma de calor más la cantidad de energía transferida en forma de trabajo sobre el sistema debe ser igual al aumento de la energía interna del sistema. El calor y el trabajo son mecanismos por los que los sistemas intercambian energía entre sí.
En cualquier máquina, hace falta cierta cantidad de energía para producir trabajo; es imposible que una máquina realice trabajo sin necesidad de energía. Una máquina hipotética de estas características se denomina móvil perpetuo de primera especie. La ley de conservación de la energía descarta que se pueda inventar nunca una máquina así. A veces, el primer principio se enuncia como la imposibilidad de la existencia de un móvil perpetuo de primera especie.
La segunda ley de la termodinámica da una definición precisa de una propiedad llamada entropía. La entropía se puede considerar como una medida de lo próximo o no que se halla un sistema al equilibrio; también se puede considerar como una medida del desorden (espacial y térmico) del sistema. La segunda ley afirma que la entropía, o sea, el desorden, de un sistema aislado nunca puede decrecer. Por tanto, cuando un sistema aislado alcanza una configuración de máxima entropía, ya no puede experimentar cambios: ha alcanzado el equilibrio. La naturaleza parece pues “preferir” el desorden y el caos. Se puede demostrar que el segundo principio implica que, si no se realiza trabajo, es imposible transferir calor desde una región de temperatura más baja a una región de temperatura más alta.
El segundo principio impone una condición adicional a los procesos termodinámicos. No basta con que se conserve la energía y cumplan así el primer principio. Una máquina que realizara trabajo violando el segundo principio se denomina “móvil perpetuo de segunda especie”, ya que podría obtener energía continuamente de un entorno frío para realizar trabajo en un entorno caliente sin coste alguno. A veces, el segundo principio se formula como una afirmación que descarta la existencia de un móvil perpetuo de segunda especie.
REACCIONES EXERGONICAS
Una reacción Exergónica es una reacción química donde la variación de la energía libre de Gibbs es negativa.[ ]Esto nos indica la dirección que la reacción seguirá. A temperatura y presión, constantes una reacción exergónica se define con la condición:
Las reacciones exergónicas son una forma de procesos exergonicos en general o procesos espontáneos y son lo contrario de las reacciones endergónicas. Se dijo que las reacciones exergónicas trancurren espontáneamente pero esto no significa que la reacción transcurrirá sin ninguna limitación. Por ejemplo la reacción entre hidrógeno y oxigeno es muy lenta y no se observa en ausencia de un catalizador adecuado.
REACCIONES ENDERGONICAS
Una reacción endergónica (también llamada reacción desfavorable o no espontánea) es una reacción química en donde el incremento de energía libre es positivo.
Bajo condiciones de temperatura y presión constantes, esto quiere decir que el incremento en la energía libre de Gibbs estandar debe ser positivo
Para una reacción en estado estándar (a una presión estándar (1 Bar), y unas concentraciones estándar (1 molar) de todos los reactivos y productos).
CONCEPTO DE ΔG0
Energía o entalpía libre de Gibbs: Espontaneidad de los procesos químicos:
Un proceso químico es espontáneo cuando no necesita de ningún agente exterior para que se produzca y será provocado cuando necesita de un agente exterior para que se produzca.
Necesitaremos de un indicador que nos diga si un proceso es provocado o espontáneo, este indicador es la energía libre o entalpía libre de Gibbs, que se define como:
Vamos a calcular la variación de G:
ΔG = Δ( H – TS ) = ΔH - TΔS – S ΔT
Si la temperatura es constante ΔT = 0 ; por lo que la expresión anterior queda:
ΔG = ΔH - TΔS
Se llama entalpía libre de la reacción a la diferencia entre la suma de las entalpías libres de los productos y la suma de las entalpías libres de los reacctivos:
ΔG = Σ np Gp - Σ nr Gr
Donde np Gp es el producto de cada uno de los coeficientes de los productos por su entalpía libre y nrGr es el producto de cada uno de los coeficientes de los reactivos por su entalpía libre.
Un proceso termodinámico es espontáneo cuando se produce algún trabajo útil, siempre que se produce un trabajo útil, coincide con que ΔG<0>0. Así por ejemplo cuando el agua se evapora, es un proceso espontáneo y el trabajo útil que se produce es el cambio de estado, por pasar de líquido a gas, el desorden aumenta y por absorber calor es endotérmico.
G = H - TS
CONCEPTO DE REACCIONES ACOPLADAS
Hay reacciones acopladas en las que el ATP es el intermediario común.A-Pi + ADP ---------------> ATP + AATP + B ----------------> ADP + B-PiEn reacciones acopladas de este tipo, la finalidad es fosforilar unintermediario para energizarlo y que pueda intervenir en el metabolismo.
1) Transferencia del fosfato al ADP.
1,3-bis-fosfoglicerato + ADP ------------------------------> ATP + 3-fosfogliceratofosfoglicerato quinasafosfoenolpiruvato + ADP ------------------------------> ATP + piruvatopiruvato quinasa
2) Transferencia del fosfato del ATP al aceptor.
ATP + Glucosa -------------------------------> ADP + Glucosa-6-fosfatohexoquinasa / glucoquinasa
Hay reacciones acopladas en las que el intermediario común no es el ATPsino un compuesto frosforiladoA + ATP ---------------> A-Pi + ADPA-Pi + B --------------------> A-B + PiLa finalidad de estas reacciones es hacer posible que tenga lugar unareacción termodinámicamente desfavorable, acoplando otra que sí lo es.
PAPEL DEL ATP EN LA CELULA
Adenosin Trifosfato (ATP), molécula que se encuentra en todos los seres vivos y constituye la fuente principal de energía utilizable por las células para realizar sus actividades. El ATP se origina por el metabolismo de los alimentos en unos orgánulos especiales de la célula llamados mitocondrias. El ATP se comporta como una coenzima, ya que su función de intercambio de energía y la función catalítica (trabajo de estimulación) de las enzimas están íntimamente relacionadas. La parte adenosina de la molécula está constituida por adenina, un compuesto que contiene nitrógeno (también uno de los componentes principales de los genes) y ribosa, un azúcar de cinco carbonos. Cada unidad de los tres fosfatos (trifosfato) que tiene la molécula, está formada por un átomo de fósforo y cuatro de oxígeno y el conjunto está unido a la ribosa a través de uno de estos últimos. Los dos puentes entre los grupos fosfato son uniones de alta energía, es decir, son relativamente débiles y cuando las enzimas los rompen ceden su energía con facilidad. Con la liberación del grupo fosfato del final se obtiene siete kilocalorías, de energía disponible para el trabajo y la molécula de ATP se convierte en ADP (difosfato de adenosina). La mayoría de las reacciones celulares que consumen energía están potenciadas por la conversión de ATP a ADP, incluso la transmisión de las señales nerviosas, el movimiento de los músculos, la síntesis de proteínas y la división de la célula. Por lo general, el ADP recupera con rapidez la tercera unidad de fosfato a través de la reacción del citocromo, una proteína que se sintetiza utilizando la energía aportada por los alimentos. En las células del músculo y del cerebro de los vertebrados, el exceso de ATP puede unirse a la creatina, proporcionando un depósito de energía de reserva.
La liberación de dos grupos fosfatos del ATP por la enzima adenilato ciclasa forma AMP (monofosfato de adenosina), un nucleótido que forma parte de los ácidos nucleicos o el material del ADN. Esta enzima es importante en muchas de las reacciones del organismo. Una forma de AMP llamada AMP cíclico originado por la acción de ésta participa en la actividad de muchas hormonas, como la adrenalina y la ACTH.


BUENISIMALA INFORMACION
ResponderEliminar