EJEMPLO
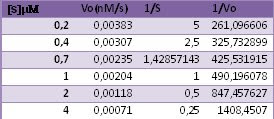
Se midio la velocidad de una reacción atalizada por una enzima los diferentes catalizadores de sustrato. Calcule los parámetros cinéticos Km y Vmax para la reacción.

INHIBICION DE ENZIMAS
El la inhibición competitiva la grafica resultante, es una inserción en la ordenada al origen.
El la inhibición acompetitiva la grafica resultante, son una rectas paralelas (tienen la misma pendiente pero diferente ordenada al origen).
En la inhibición no competitiva la grafica resultante es una intersección en las abscisas.
ENZIMAS DE IMPORTANCIA MÉDICA
TGO Y TGP
TGO Y TGP
La administración de un aminoácido con nitrógeno isotópico va seguida de la aparición de dicho nitrógeno en numerosos aminoácidos de las proteínas tisulares; es decir, el organismo utiliza el nitrógeno de un aminoácido para las síntesis de otros. Esta reacción general de traspaso de nitrógeno de uno a otro aminoácido se denomina transaminación y en ella participan un aminoácido y un cetoácido.
Las reacciones de transaminación mas frecuentes son aquellas en las que participa en alfa-cetoglutarato cuya aminación produce glutamato.
La reacción precedente corresponde a la catalizada por la Transaminasa Glutámico Pirúvica (TGP) siendo igual para la que cataliza la Transaminasa Glutámico Oxaloacetica (TGO), solamente cambiando el aminoácido por aspartato y el cetoácido por oxaloacetato, es por eso que se les llama también Alanino Aminotransferasa (ALT) y Aspartato Aminotranferasa (AST), respectivamente, por el aminoácido utilizado.
La TGO y la TGP son importantes en la clínica y su aumento se debe a un proceso necrótico en órganos con alta funcionalidad como lo es el hígado y el miocardio. En lesiones hepáticas aumentan ambas transaminasas en el suero.
Las transaminasas también se elevan en casos de cirrosis e ictericia por obstrucción; en las ictericias por lesión hepatocelular, su elevación es muy marcada, coincidiendo con una elevación muy baja o nula de fosfatasa alcalina, mientras en las obstrucciones las transaminasas suben de modo discreto y la fosfatasa alcalina se encuentra elevada.
El tejido miocárdico es muy rico en TGO y el ascenso de esta enzima acompaña a los procesos destructivos del corazón; sube al máximo entre las 12 y 48 horas y suele volver a lo normal a los 4 ó 7 días
La TGO y TGP aparece en el plasma sanguíneo en bajas concentraciones, pero cuando estás están elevadas casi siempre indican una alteración hepática o un infarto, esas elevaciones aparecen en el caso de la hepatitis, cirrosis, ictericia.
Los valores normales de la TGO son entre:
10 – 38 U/mL
Y TGP:
5 - 35 U/mL
DIAGNOSTICO
TGO
1. Pipetear 1.0 ml. del reactivo reconstituido en los tubos etiquetados como Blanco, Patrón y Muestra.
2. Precaliente los tubos a 37ºC. por 5 minutos.
3. Ajustar el espectrofotometro a cero de absorbancia en 340 nm usando agua destilada.
4. Coloque 0.1 ml. de la muestra dentro del tubo apropiado, mezcle e incube a 37ºC. por dos minutos.
5. Después de los dos minutos de preincubación, lea la absorbancia (A1), regresar el tubo al incubador de 37ºC.
6. Después de exactamente un minuto lea la absorbancia (A2), dos veces y promediar las lecturas.
CALCULOS
(A1-A2) X 1.1 X 1000
------------------- = (A1-A2) X 1786
1 x 6.22 X 0.1
DONDE
(A1-A2 ) = Cambio en absorbancia
1.1 = Volumen total de la reacción en ml.
1000 = Conversión de IU/ml a IU/L
1 = Amplitud del paso de luz en cm.
6.22 = Absorptividad milimolar del NADH
0.1 = Volumen de la muestra en ml.
VALORES DE REFERENCIA
Menos de 28 IU/L (30ºC.)
Menos de 40 IU/L (37ºC.)
TGP
1. Pipetear 1.0 ml. del reactivo reconstituido en tubos perfectamente etiquetados como control, muestra y patrón.
Precalientar los tubos a 37ºC. por 5 min.
2. Ajustar el espectrofotómetro a cero de Absorbancia a 340nm usando agua desmineralizada.
3. Colocar 0.1 ml. de la muestra en el tubo, mezcle e incube a 37ºC por 1 minuto.
4. Después de 2 minutos de preincubación leer la absorbancia ( A 1), coloque nuevamente el tubo a 37ºC.
5. Después de 1 minuto exacto lea la Absorbancia (A2) y registrar.
CALCULOS
(A1 - A2 ) X 1.1 X 1000
IU/L = ------------------------------------------- = (A1 - A2) X 1768
1 X 6.22 X 0.1
DONDE:
(A1 - A2) = Cambio de absorbancias
1.1 = Volumen total de la reacción en ml.
1000 = Conversión IU/ml. a IU/L
1 = Espesor de la cubeta en cm.
6.22 = Absorptividad milimolar del NADH.
0.1 = Volumen de la muestra
VALORES DE REFERENCIA
Menor que 26 U/L ( 30ºC.)
Menor que 38 U/L (37ºC.)
ENZIMAS HEPATICAS
Fosfatasa alcalina del suero
Esta enzima procede de manera principal de los huesos y también en parte del hígado. La fosfatasa alcalina aumenta por lo común en los periodos de crecimiento y reparación ósea. Un aumento normal considerable se presenta en las ictericias obstructivas; en la insuficiencia hepática crónica como la cirrosis, puede aumentar de forma leve.
Aldulasa ‹‹hepática››
Es la enzima fosfofructoaldulasa o fructosa 1-fosfatoaldulasa, se le denomina también Aldulasa hepática porque existe de manera casi exclusiva en el hígado y de ahí, su importancia clínica. No existe en la sangre en condiciones normales aparece en ella en las lesiones hepáticas. Es mayor su cantidad sanguínea cuando el grado de daño hepatocelular se incrementa de manera progresiva.
Lactato deshidrogenasa
La deshidrogenasa del acido láctico o lactato deshidrogenasa, presente en la sangre, participa en la conversión de piruvato a lactato y viceversa. En la hepatitis aguda con ictericia y a veces en los trastornos hepáticos crónicos aumenta su concentración en sangre.
Malato e isocitrato deshidrogenasas
Estas enzimas se incrementan de forma notable en las hepatitis agudas y en menor grado en la cirrosis. Su función se relaciona con reacciones de oxidación a nivel de la mitocondria, en la vía metabólica del Ciclo de Krebs.
Transaminasas (aminotransferasas)
Son enzimas del metabolismo de aminoácidos participan en reacciones de transaminacion, es decir, el intercambio de grupos funcionales amino de los aminoácidos, por grupos cetonas de los cetoacidos. En general la enzima transaminasa glutamico oxalacetica (TGO) se eleva menos que la transaminasa glutamico piruvica (TGP), en las hepatitis agudas. En la cirrosis hepática también se presenta ligero aumento de estas enzimas. En la actualidad la TGO también se conoce como aspartatoaminotransferasa (AST) y la TGP como alaninaminotransferasa (ALT).


Hola, que tal ???
ResponderEliminarme parece super interesante y util tu pagina.
Que me podrias decir de la bioquimica de colageno tipo 1? te lo agradecere mucho, mi correo es metal.shredder@gmail.com
saludos!!
Esta muy bien al información y por consiguiente bien estrcuturada.
ResponderEliminarSaludos..
no se si pudieras poner la bibliografia de tu trabajo ya que esta muy bien explicado y estructurado.
ResponderEliminarhola mira me parecio muy bueno tu trabajo solo que tengo problemas para estructurar o hacer un acurva patro de la piruvato transaminasa crees poder ayudarma
ResponderEliminarmi correo es ittzyeg_@hotmail.com
gracias solo q me urge un poco
mmm.... esta mal mi correo te lo dejo de nuevo ittzyrg_@hotmail.com soy la de arriba ok
ResponderEliminaresta muy interesante tu informacion me ayudo muchisimo
ResponderEliminarmuchas gracias
mi correo es: senaida_26@hotmail.com
si puedes escribeme
MUY BUENA LA LITERATURA Y BASTANTE CLARO EL EJEMPLO.A LOS QUE TRABAJAN CON ESA RAMA DE LA MEDICINA Y A LOS BIONALISTAS LES AYUDA MUCHO.FELICITACIONES
ResponderEliminartransaminasas reaccion que cataliza (sustratosobre el que actua yel producto que forma )de la TGP yTGO
ResponderEliminarluistu_men@hotmail.com de transaminasas
ResponderEliminarPORFAVOR, SOY ESTUDIANTE DE MEDICINA Y ME GUSTARIA TENER MAS INFORMACION SOBRE LA IMPORTANCIA MEDICA DE LA EMZIMAS..
ResponderEliminarGFRACIAS
MI CORREO ES: maylee_lucero@hotmail.com
perfecto ,sencillo ,facil de entender y bien explicito. felicitaciones
ResponderEliminar